
百灵佳殷格翰近(20)日公布FIBRONEER™ – IPF与FIBRONEER™ – ILD第三期临床试验的详细研究结果。这两项研究评估Nerandomilast ─ 一种研究性口服磷酸二酯酶4B (PDE4B)抑制剂,作为特发性肺纤维化(IPF)和渐进性肺纤维化(PPF)患者中的疗效与安全性,无论是否整合使用现有抗纤维化药物治疗。
两项研究结果皆已发表在《新英格兰医学期刊》(New England Journal of Medicine),并于2025年美国胸腔医学会(ATS)国际年会中以突破性摘要形式发布。
Nerandomilast为研发中临床试验新药,目前尚未获准上市;其疗效与安全性尚未获得确立。
两项试验在9毫克与18毫克两种剂量下皆完成主要主要疗效指标,即在第52周时,相较安慰剂,显著减缓用力呼气肺活量(FVC)绝对变化量的下降(注1、2)。用力呼气肺活量是一种衡量肺功能的指标(注3)。
“即便科学界多次挑战新的临床试验进展,特发性肺纤维化(IPF)与渐进性肺纤维化(PPF)这两个疾病仍对患者造成严重负担,”南加州大学凯克医学院临床医学教授Toby Maher(M.D. Ph.D)表示。“这两项第三期临床试验皆完成主要评估指标,对科学界而言是一项重大突破,突显了nerandomilast无论作为单一疗法或与现有治疗并用,皆具备回应患者未满足之医疗需求潜力。”
在两项试验中,nerandomilast组与安慰剂组的永久停药率相近:在FIBRONEER™- IPF试验中,因不良事件导致永久停药的比例分别为nerandomilast 18毫克组14.0%、9毫克组11.7%、以及安慰剂组10.7%(注1、2)。在FIBRONEER™- ILD试验中,该比例分别为nerandomilast 18毫克组10.0%、9毫克组8.1%、以及安慰剂组10.2%(注2)。在这两项试验中,nerandomilast组与安慰剂组在特别关注的不良事件方面(如血管炎、抑郁、自杀倾向或药物性肝损伤)并无显著差异(注1、2)。
“特发性肺纤维化(IPF)与渐进性肺纤维化(PPF)是极具破坏性的疾病,IPF患者中有一半在确诊后五年内死亡。尽管现实残酷,持续研究仍为患者带来新的希望,因为目前仍有迫切的治疗需求未被满足,”百灵佳殷格翰人用药业务部负责人暨董事会成员Shashank Deshpande表示。“nerandomilast最新的疗效、安全性与耐受性数据显示,其有潜力成为改善IPF与PPF患者生活的重要治疗选项。”
FIBRONEER™- IPF:临床实验设计与研究结果(注1)FIBRONEER™- IPF(NCT05321069)是一项第三期、双盲、随机、安慰剂对照的临床试验,评估nerandomilast在特发性肺纤维化(IPF)患者中,为期至少52周的疗效与安全性。试验共纳入来自36个国家的1,177位患者,并以1:1:1的比例随机分配接受每日两次的nerandomilast 9毫克(n = 392)、18毫克(n = 392)或安慰剂(n = 393)治疗。随机分组时依据患者是否使用背景抗纤维化治疗进行分层,其中有77.7%的患者在入组时已使用nintedanib或pirfenidone。
第52周的主要疗效结果已发表在《新英格兰医学期刊》,包括:
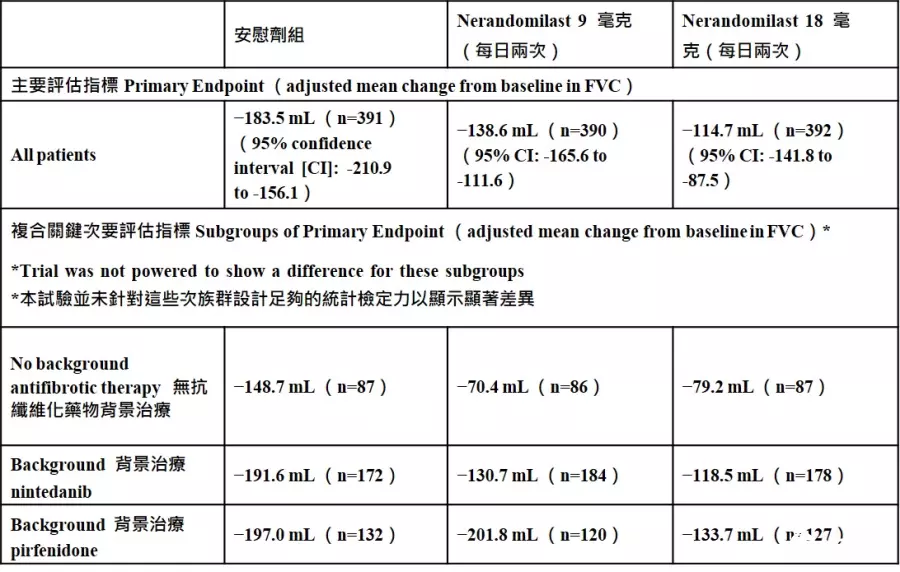
本次复合关键次要评估指标[首次急性恶化、因呼吸原因住院,或死亡的时间(从试验开始至事件发生的时间)]未完成统计显著性。
最常见的不良事件为腹泻,分别发生于安慰剂组16.0%、nerandomilast 9毫克组31.1%、以及18毫克组41.3%的患者中。导致试验用药终止最常见的不良事件也为腹泻,分别导致nerandomilast 9毫克组1.8%、18毫克组6.1%、以及安慰剂组0.5%的患者停药。其他不良事件在各治疗组间分布均衡,特别是在血管炎、抑郁、自杀倾向或药物性肝损伤等特别关注的不良事件方面,nerandomilast组与安慰剂组之间并无显著差异。
FIBRONEER™- ILD:临床实验设计与研究结果(注2)FIBRONEER™ – ILD(NCT05321082)是一项第三期、双盲、随机、安慰剂对照的临床试验,评估nerandomilast在渐进性肺纤维化(PPF)患者中,为期至少52周的疗效与安全性。试验共纳入来自44个国家的1,176位患者,并以1:1:1的比例随机分配接受每日两次的nerandomilast 9毫克(n=393)、18毫克(n=391)或安慰剂(n=392)治疗。随机分组时依据患者是否使用背景抗纤维化治疗进行分层,其中有43.5%的患者在入组时已使用nintedanib。
第52周的主要疗效结果已发表在《新英格兰医学期刊》,包括:
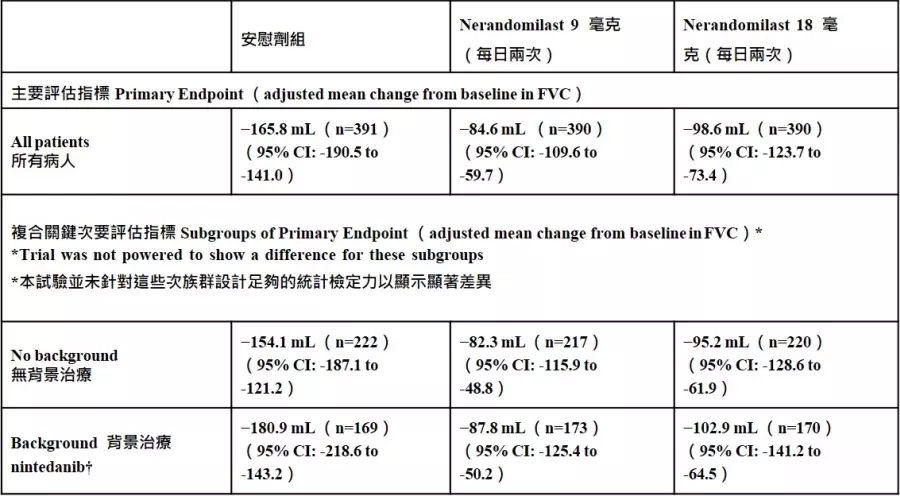
在本试验中,有2位患者实际使用pirfenidone而非nintedanib,虽被归类为试验偏差(protocol deviations),但其数据仍纳入背景使用nintedanib治疗组进行分析。
Nerandomilast在复合关键次要评估指标[首次急性恶化、因呼吸原因住院,或死亡的时间(从试验开始至事件发生的时间)]上未达统计显著差异,但在死亡率方面,两个治疗组的死亡人数皆低于安慰剂组:9毫克组为33人(8.4%)、18毫克组为24人(6.1%),而安慰剂组为50人(12.8%)。
Nerandomilast的安全性与耐受性概况与FIBRONEER™- IPF试验结果大致一致。最常见的不良事件为腹泻,于52周内的发生率分别为安慰剂组24.7%、nerandomilast 9毫克每日两次组29.5%、以及18毫克每日两次组36.6%。在特别关注的不良事件方面,如血管炎、抑郁或自杀倾向,nerandomilast组与安慰剂组之间并无显著差异。导致停药最常见的不良事件为“病情恶化”(即肺纤维化恶化),其发生率分别为nerandomilast 9毫克组1.5%、18毫克组1.0%、安慰剂组3.1%;其次为腹泻,分别导致1.3%、2.6%、与0.5%的患者停药。
无论是否整合使用nintedanib作为背景治疗,导致停药的不良事件发生率整体相近。严重不良事件的发生率分别为安慰剂组35.2%、nerandomilast 9毫克组31.8%、以及18毫克组33.2%。不良事件导致死亡的比例则分别为安慰剂组5.1%、 nerandomilast 9毫克组3.6%、以及18毫克组2.0%。
关于nerandomilastNerandomilast (BI 1015550) 是一种研究性口服磷酸二酯酶4B (PDE4B) 抑制剂,正研究其作为特发性肺纤维化 (IPF) 和渐进性肺纤维化 (PPF) 潜在疗法的可能性(注1、2)。
Nerandomilast于2022年2月以及2025年4月份别获得美国食品药物管理局(FDA)授给的特发性肺纤维化 (IPF) 突破性疗法认定。美国食品药物管理局(FDA)近期已受理nerandomilast用于治疗特发性肺纤维化(IPF)的新药申请(NDA),并授给优先审查资格,预计将于2025年第四季作出审查决议。此外,nerandomilast用于渐进性肺纤维化(PPF)的新药申请也已提交至FDA审查中。
针对IPF与PPF的适应症,nerandomilast的药证申请目前也正由中国与欧盟相关主管机关审查中,其他地区的申请作业也将陆续展开。
关于特发性肺纤维化(IPF)与渐进性肺纤维化(PPF)特发性肺纤维化(IPF) 是较常见的一种渐进性纤维化间质性肺病 (ILD)(注4)。在特发性肺纤维化(IPF)中,其肺部纤维化的发病原因尚不明确。IPF的症状包括活动时呼吸困难、干咳和持续性咳嗽、疲劳与虚弱(注5)。该疾病主要影响50岁以上的患者,且男性患者多于女性(注5)。
除了特发性肺纤维化(IPF)之外,某些特定类型的纤维化间质性肺病(ILD)患者也可能发展出一种称为渐进性肺纤维化(PPF)的渐进性表现型(注6)。在PPF中,间质性肺病往往有已知的潜在疾病原因,例如类风湿性关节炎或系统性硬化症。在特发性肺纤维化以外的间质性肺病中,PPF的定义包括呼吸症状恶化、疾病进展的生理学证据,以及疾病进展的放射形象学证据(注6)。
IPF与PPF的盛行率因地区而异。据估计,全球可能有多达360万人受到IPF影响,PPF则可能影响多达560万人(注7、8)。
(首图来源:shutterstock;数据源:百灵佳殷格翰)











